Transplantationschirurgie
ÄrztInnenteam:
OA Univ.-Prof. Dr. Rupert Oberhuber, PhD, FEBS (Leitung)
FA Dr. Ruben Bellotti
OA Priv.-Doz. Dr. Benno Cardini, FEBS
OÄ Priv.-Doz.in Dr.in Katrin Kienzl-Wagner
OA Assoz. Prof. Priv.-Doz. Dr. Manuel Maglione, MBA, FEBS
OA Priv.-Doz. Dr. Herbert Maier
OA Priv.-Doz. Dr. Christian Margreiter, FEBS
OÄ Priv.-Doz.in Dr.in Franka Messner-Rooprai, PhD, FEBS
FA Dr. Andras Meszaros, PhD
OA Priv.-Doz. Dr. Thomas Resch, PhD, FEBS
OA Dr. Stefan Scheidl, FEBS
Univ.-Prof. Dr. Stefan Schneeberger, MBA, FEBS
Sprechstunde: Di 08.00 – 13.00 Uhr
Tel.: +43 512 504 22603
lki.ch.transplant-office@tirol-kliniken.at
A-6020 Innsbruck, Anichstraße 35, Haus 8, EG, Ambulanz
Transplant-Koordination (besetzt 24/7):
Tel. +43 512 504 22603, Raum 8-G12-041
lki.ch.transplant-office@tirol-kliniken.at bzw. sandra.baher@tirol-kliniken.at
Sandra Baher
Elias Loewit
Julia Mader
Anna Scheiber
Kristina Strobl
Stephanie Wörgötter
A-6020 Innsbruck, Anichstraße 35, Haus 8, 12. Stock, nach der Lifthalle auf der linken Gangseite

An der Klinischen Abteilung für Visceral, Transplantations- und Thoraxchirurgie werden folgende Organtransplantationen durchgeführt:
Nierentransplantation
Lebertransplantation
Pankreastransplantation
Dünndarm- und Multiviszeraltransplantation
Handtransplantation
Zuweiserinformation für BehandlerInnen von PatientInnen mit Lebermetastasen bei kolorektalem Karzinom (mCRC)
Innerhalb einer klinischen Beobachtungsstudie (EK-Nummer: 1050/2019) bieten wir die Lebertransplantation für PatientInnen mit Lebermetastasen eines kolorektalen Karzinoms als Therapieoption an. Nach dem derzeitigen Stand des Wissens kann damit bei ausgewählten PatientInnen ein enormer Überlebensvorteil im Vergleich zur bisherigen Standardtherapie erreicht werden.
Um eine längere Wartezeit zu vermeiden, ist die Transplantation mittels Lebendspende eine Option die individuell geprüft werden kann. Falls bei Ihnen eine Patientin/ein Patient in Behandlung ist, die/der davon profitieren könnte, bitte wir Sie um Kontaktaufnahme.
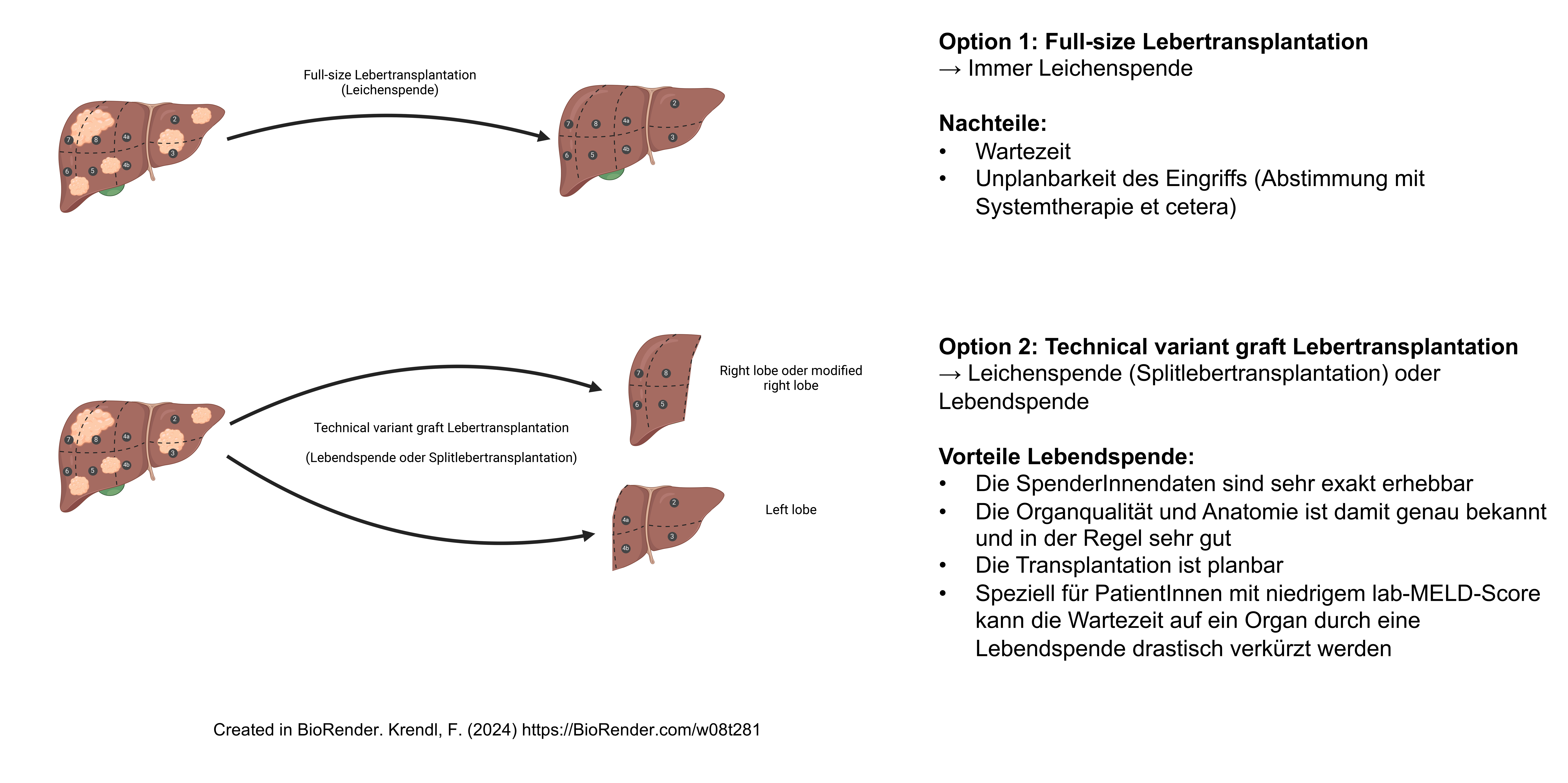
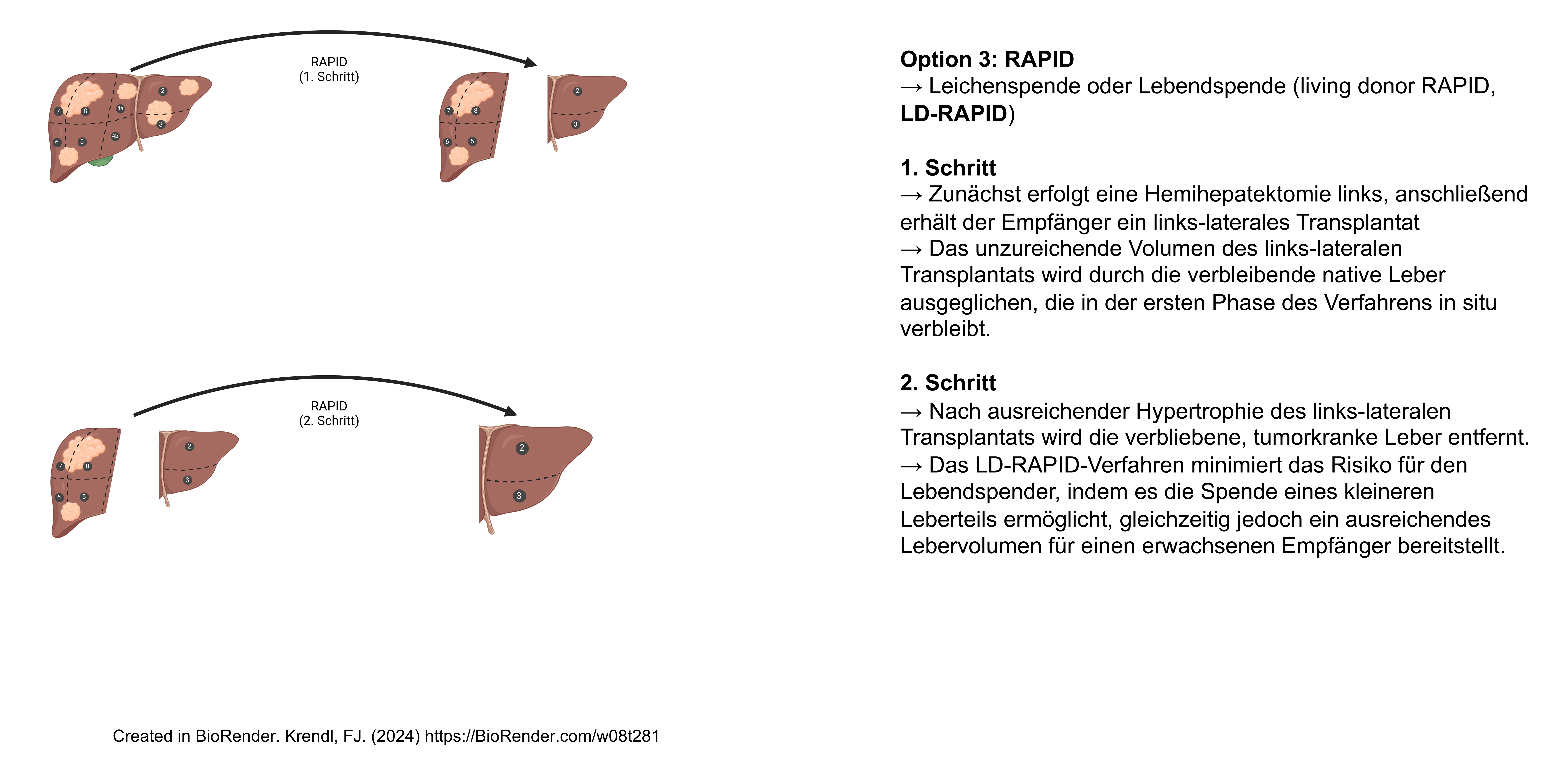
Kriterien, um prinzipiell für eine Lebertransplantation (LTx) in Frage zu kommen:
- Nicht-resektable kolorektale Lebermetastasen (nrCRLM)
- Keine extrahepatischen Metastasen
- BRAF V600Ewt
- Mikrosatelliten-stabiler Tumor (mismatch repair proficient)
- Linksseitiges Primum, histologisch verifiziert
Weitere Kriterien die vor der Lebertransplantation erfüllt sein müssen:
- R0 Resektion des Primärtumors nach onkologischen Kriterien
- Stabile Tumorerkrankung (SD oder PR der Lebermetastasen) für mindestens 6 Monate unter Systemtherapie
- Bevorzugt: CEA < 80 μg/L oder Reduktion um mindestens 50% vom Ausgangswert
- Relative Kontraindikation: CEA > 80 μg/L mit rückläufiger Tendenz
- Absolute Kontraindikation: CEA > 80 μg/L mit steigender Tendenz
- Bevorzugt: Metabolisches Tumorvolumen (MTV) ≤ 70 ml
- Bevorzugt: Weniger als 4 positive, regionale Lymphknoten im Kolonresektat (N2 = relative Kontraindikation)
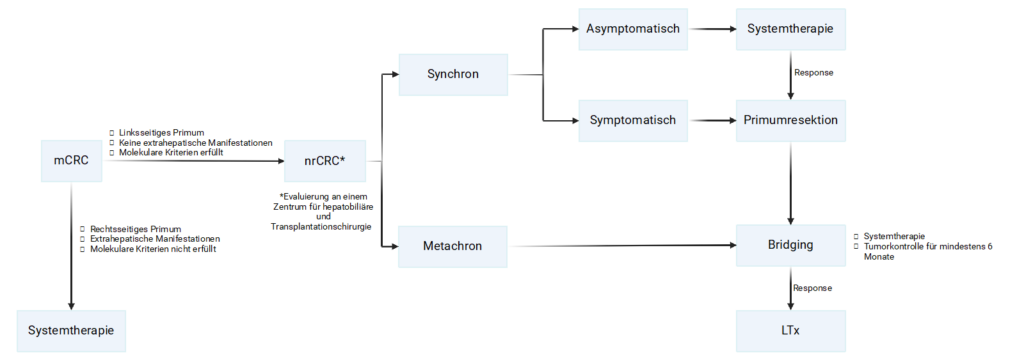
Therapiepfad zur Lebertransplantation
In der u.a. Abbildung sind die Schritte von der Erstdiagnose zur Lebertransplantation abgebildet. Abweichungen von diesem Pfad sind möglich, sollten aber im Einzelfall geprüft werden. Die Kontaktaufnahme zur Prüfung der Kriterien sollte nach Möglichkeit früh nach Diagnosestellung erfolgen, um die Lebertransplantation als Option bei der Behandlung berücksichtigen zu können.
Ansprechpartner Onkologische Transplantation
Univ.-Prof. Dr. Stefan Schneeberger, MBA, FEBS
Assoz. Prof. Priv.-Doz. Dr. Rupert Oberhuber, PhD, FEBS
Dr. Felix J. Krendl
Kontaktaufnahme unter lki.ch.transplant-office@tirol-kliniken.at
Weiterführende Literatur
- Bonney GK et al. Liver transplantation for non-resectable colorectal liver metastases: the International Hepato-Pancreato-Biliary Association consensus guidelines. Lancet Gastroenterol Hepatol. Nov 2021;6(11):933-946. Lancet Gastroenterol Hepatol. doi:10.1016/s2468-1253(21)00219-3
- Krendl FJ et al. Transplant oncology – Current indications and strategies to advance the field. JHEP Reports. 2024;6(2)doi:10.1016/j.jhepr.2023.100965
- Adam R et al. Liver transplantation plus chemotherapy versus chemotherapy alone in patients with permanently unresectable colorectal liver metastases (TransMet): results from a multicentre, open-label, prospective, randomised controlled trial. Lancet. Sep 21 2024;404(10458):1107-1118. doi:10.1016/s0140-6736(24)01595-2
- Dueland S et al. Long-Term Survival, Prognostic Factors, and Selection of Patients With Colorectal Cancer for Liver Transplant: A Nonrandomized Controlled Trial. JAMA Surg. Jul 26 2023:e232932. doi:10.1001/jamasurg.2023.2932
Nierentransplantation
Die häufigsten Grunderkrankungen entsprechend internationalen Statistiken sind: Chronische Glomerulonephritis, Diabetische Nephropathie, Polyzystische Nierenerkrankung, Chronische, Pyelonephritis/interstitielle Nephritis, Schwere Missbildungen des Nieren-/Harnabflusstraktes, Schwere Hochdruckerkrankung
Seltenere Grunderkrankungen sind u.a.: Good Pasture Syndrom, Lupus erythematodes, Wegener’sche Granulomatose, Alport-Syndrom, Schwangerschafts-Gestose, Hämolytisch-urämisches Syndrom, Schwere Nierenschädigung durch Schmerzmittel (=Analgetikanephropathie), Medikamentbedingte chronische Nierenerkrankung
In Einzelfällen ist jede vorliegende fortschreitende Nierenerkrankung auf ihre Heilbarkeit zu überprüfen, bevor die Indikation zur Nierentransplantation gestellt wird. Diese erfolgt gemeinsam mit dem Transplantationschirurgen nach ausführlichen Voruntersuchungen und Vorgesprächen mit dem Patienten. Die Wartezeit auf eine Nierentransplantation beträgt an unserem Zentrum derzeit ca. zwei bis sechs Jahre, wobei hervorgehoben sei, dass die Zuteilung von passenden Spendernieren an Empfänger streng über die Organisation „Eurotransplant“ (Sitz in Leiden, Niederlande) entsprechend Gewebsgruppen-Ähnlichkeit (=HLA-Histokompatibilität) erfolgt mittels Computerberechnung nach Vorliegen der jeweiligen Blutgewebsgruppenbefunde von Spender und Empfänger. Die bedauerlicherweise lange Wartezeit erklärt sich aus der zunehmenden Zahl an Patienten, die eine Nierentransplantation wünschen und dem leider international bekannten allgemeinen Spenderorganmangel.
Eine günstige Option in dieser Problemsituation ist die Nieren-Lebendspende.
Es gibt zur Nierentransplantation keine definitive Altersgrenze. Vorbehaltlich der körperlichen Voraussetzungen (überprüft anhand von Voruntersuchungen) kann man vom Kleinkindesalter bis ins betagte Seniorenalter Nieren transplantieren. Hervorgehoben sei das erfolgreiche Eurotransplant-Seniorprogramm, das die Übertragung von Nieren von über 65-jährigen Spendern an ebenfalls über 65-jährige Empfänger vorsieht und gute Langzeitergebnisse aufweist. Ziel unseres Nieren-Transplantationsprogrammes ist die Gewährleistung einer stabilen Nieren-Langzeitfunktion mit guter Lebensqualität, möglichst früher Wiederaufnahme der beruflichen Tätigkeit und der Umsetzung privater/familiärer Interessen.
Nierenlebendspende
Gibt es nach reiflicher Überlegung, umfangreichen Untersuchungen und Beratungen im familiären Umfeld oder dem emotional nahestehenden Bekanntenkreis eine zur freiwilligen Nierenspende bereite Person wird diese ebenfalls einem intensiven medizinischen Check-Up unterzogen. Dabei werden der allgemeine Gesundheitszustand des Spenders, dessen medizinisches Eignung als Nierenspender sowie die Anatomie und Qualität der potentiellen Spenderniere genau evaluiert. Spender und Empfänger müssen sich außerdem einem ausführlichen psychologischen Beratungsgespräch unterziehen. Sind alle medizinischen und psychologischen Voraussetzungen erfüllt wird dem Spender in einem – in der Regel minimal-invasiv (d.h. in „Schlüsselloch-Technik“) durchgeführten Eingriff – eine Niere entfernt und auf den Empfänger übertragen (Operationstechnik siehe unten).
Einer der großen Vorteile der Nieren-Lebendspende liegt in der Planbarkeit des Operationszeitpunktes. Während der Empfänger an der Dialyse auf das Spenderorgan eines Verstorbenen kann sich sein Gesundheitszustand oft langsam verschlechtern. Die frühe Durchführung einer Lebendspende (ev. sogar als vorbeugende Transplantation noch bevor der Empfänger dialysepflichtig wird) kann dies verhindern. Der Empfänger ist zum Zeitpunkt der Transplantation daher „gesünder“ und erholt sich somit rascher von dem Eingriff. Ein weiterer Vorteil liegt in der besseren Organqualität, da das Spenderorgan sorgfältig ausgesucht werden kann. Zudem kann durch die Planbarkeit des Eingriffes die Zeit zwischen Organentnahme und –transplantation, in der die Spender gekühlt und gelagert werden muß (sog. „kalte Ischämie-Zeit“), auf ein Minimum reduziert werden. Die Folge sind im Vergleich zur Verstorbenen-Spende deutlich bessere Ergebnisse, d.h. längeres Patientenüberleben und längere Funktionsdauer der transplantierten Nieren. Im Schnitt beträgt das 5-Jahres-Transplantatüberleben (= der Prozentsatz an Nieren, die fünf Jahren nach der Transplantation noch eine gute Funktion aufweisen) in etwa 90%.
Der Eingriff der Nierenentnahme wie auch das anschließende Leben mit nur einer Niere sind für den Spender nicht ganz risikofrei. Die Operation selbst weist die üblichen, jedoch im Vergleich zu anderen großen Baucheingriffen eher geringen Risiken von Operationskomplikationen (z.B. Nachblutungen oder Infektionen) auf. Zudem besteht für den Spender ein im Vergleich zur Gesamtbevölkerung etwas erhöhtes Risiko in den nächsten 10 bis 20 Jahren Bluthochdruck (arterielle Hypertonie) oder eine andere Herz-Kreislauf-Erkrankung zu entwickeln. Dies scheint alle, jedoch insbesondere ältere Spender zu betreffen. Ca. 30% aller Spender über 60 Jahre entwickeln innerhalb von 5-10 Jahren einen therapiebedürftigen Bluthochdruck. Das Risiko nach Spende einer Niere innerhalb von 10 Jahren selbst dialysepflichtig zu werden wird auf etwa 1% geschätzt. Wenngleich die Risiken für den Spender insgesamt überschaubar sind so sollte angesichts dieser Zahlen nochmals auf die absolute Freiwilligkeit einer Nierenspende hingewiesen werden. Weiters sollten sich alle Spender nach der Nierenentfernung regelmäßigen Kontrollen beim Internisten unterziehen. Dem stationären Aufenthalt des Spenders von üblicherweise 5-10 Tagen folgt eine Erholungsphase von üblicherweise 4-6 Wochen.
Hier wird nach exakter medizinischer Voruntersuchung einer zur freiwilligen Spende bereiten Person aus familiärem oder emotional nahestehendem Bekanntenkreis nach genauer medizinischer Überprüfung der Nierenqualität, klinischer Eignung und Anatomie eine Spenderniere an den Empfänger übertragen (Operationstechnik siehe unten). Der Vorteil bei der Nieren-Lebendspende liegt in der Planbarkeit des Operationszeitpunktes, einer kurzen Wartezeit und insbesondere sehr kurzen „kalten Ischämiezeit“ (= Zeit der Niere außerhalb des Blutkreislaufes), welche bei Nieren von fremden verstorbenen Spendern aufgrund möglicher längerer Transportwege länger ist.
Operationstechnik
Die Spenderniere wird dem Empfänger über einen bogenförmigen Schnitt in den linken oder rechten Unterbauch, jedoch unterhalb der eigentlichen Bauchhöhle, transplantiert. Damit die Niere im Emfpänger ihre normale Funktion aufnehmen kann müssen ihre Gefäße an die Blutversorgung des Empfängers angeschlossen werden. Die Nierenschlagader und –vene werden dabei mit den Beckengefäßen, i.e. der Beckenschlagader bzw. –vene des Empfängers erbunden. Der an der Spenderniere befindliche Harnleiter wird in die Harnblase eingenäht. Zur Schonung der Naht wird während der Operation eine Schienung (=Splint) eingelegt. Der Splint wird zu einem späteren Zeitpunkt mittels Blasenspiegelung entfernt. Weiters wird am Ende der Operation ein kleiner Ableitungsschlauch (=Redon-Drainage) in das Operationsgebiet eingelegt, um etwaige Reste von Gewebsflüssigkeit oder Blut nach außen abzuleiten. Diese Drainage wird ebenfalls nach wenigen Tagen entfernt. Nach der Operation werden regelmäßige Ultraschall-Kontrollen, sowie tägliche Laborkontrollen der Blutwerte des Patienten, insbesondere der Nierenfunktionswerte, durchgeführt. Zur genauen Anpassung der Immunosuppression (siehe unten) müssen zudem die Blutkonzentrationen der entsprechenden Medikamente täglich bestimmt werden. Dies dient der anhaltenden Vorbeugung gegen etwaige Abstoßungsreaktionen. In einigen Fällen sind nach der Operation, falls die Niere etwas „Anlaufzeit“ benötigt, einige Dialysen notwendig, bis das Transplantat eine optimale Blutwäschefunktion und Harnproduktion erbringt. Eine akute Abstoßungsreaktion entspricht einer Abwehrreaktion des körpereigenen Immunsystems gegen das transplantierte, fremde Gewebe. Mittels sorgfältiger engmaschiger Untersuchungen (Laborchemie, Ultraschall, Nierengewebsprobenentnahme = Biopsie) kann eine akute Abstoßungsreaktion rasch erkannt und fast immer erfolgreich behandelt werden: die sogenannte zelluläre (= durch T-Lymphozyten verursachte) Abstoßungsreaktion spricht sehr gut auf eine hoch dosierte Kortison-Therapie an. Die seltenere, „Antikörper-vermittelte“ Abstoßungsreaktion bessert sich durch Plasmaaustausch (Eliminierung der Antikörper), ergänzt durch medikamentöse Infusionstherapie zur Unterdrückung von Lymphozyten. Bei problemlosem Verlauf kann der Patient mit stabiler Transplantatfunktion nach 1 bis 3 Wochen in gutem Allgemeinzustand entlassen werden unter Vereinbarung regelmäßiger ambulanter Nachkontrollen an unserem Zentrum oder in guter Zusammenarbeit mit den Heimatzentren von Patienten, die geographisch weiter entfernt wohnen.Bei etwaigen Rückfragen oder Problemen sind wir stets telefonisch erreichbar!
Immunosuppression
Die Annahme des fremden Nierentransplantates im Empfängerorganismus ist keine Selbstverständlichkeit. Vielmehr wäre der Empfängerorganismus biologisch bereit, das neue Gewebe als fremd zu erkennen und mittels Entzündungsreaktion abzuwehren (Abstoßung). Um diesen Schritt zu verhindern, wird bereits ab dem Zeitpunkt der Transplantation eine medikamentöse Therapie gegen das körpereigene Abwehrsystem zu verabreicht, die anfangs auch Kortison beinhaltet, das im längerfristigen Verlauf dann reduziert, im Idealfall abgesetzt werden kann. Es wird eine Kombination von Medikamenten verabfolgt, die die Vermehrungsbereitschaft der Abwehrzellen (=Lymphozyten) unterdrücken, ohne diese jedoch völlig zu zerstören, da man sie für andere Schutzfunktionen (gegen Infektionen und Tumore) benötigt. Eine Reihe vom Medikamenten sind zu dieser Abstoßungsvorbeugung geeignet: eine Kombination von i) Kalzineurinhemmern (Tacrolimus oder Cyclosporin-A), ii) einem Hemmer der Zellteilung (Mycophenolsäure, mTOR-Hemmer, Azathioprin) und iii) Kortison haben sich bewährt. Diese Medikamente sind eine Langzeit-Dauertherapie, deren Dosis jedoch längerfristig deutlich reduziert werden kann, sodass unter dieser Medikation eine gute Lebensqualität und körperliche Leistungsfähigkeit möglich ist. Zusätzlich wird zur Einleitung der Immunsuppression bei vielen Patienten ein Antikörper während und kurz nach der Transplantation verabreicht, der die Zahl der Immunzellen im Empfänger reduziert. Eine wichtige Aufgabe der oben erwähnten regelmäßigen ambulanten Nachkontrollen ist die Dosiskontrolle und Wirkspiegelbestimmung jener Medikamente zwecks Vermeidung von Über- oder Unterdosierung und potenziellen Nebenwirkungen. Da aus Patienten- bzw. Ärztesicht und der pharmazeutischen Industrie großes Interesse an der Optimierung jener Therapie und deren Weiterentwicklung besteht, darf in den nächsten Jahren durchaus mit der Zulassung neuer immunosuppressiver Medikamente gerechnet werden.
Nebenwirkungen der Immunosuppression
Aufgrund der künstlich unterdrückten Abwehrlage ist insbesondere in der ersten Phase nach der Transplantation mit einem erhöhten Infektionsrisiko zu rechnen, worüber die Patienten in Vorgesprächen vor der Transplantation und während des stationären Aufenthaltes eingehend informiert und beraten werden. Man plant eine Entlassung nach der Transplantation dann, sobald der Patient sich infektiologisch sicher fühlen kann, wobei in den ersten zwei Monaten nach der Transplantation ein behutsamer Umgang mit potenziellen Infektionsquellen empfohlen wird: Abzuraten ist in dieser Phase von größeren Menschenansammlungen, unmittelbarem Kontakt mit infektiösen Personen oder starker Staub- und Schmutzexposition. Im Verlauf der nachfolgenden Monate wird dieses Risiko kleiner, da die genannten Medikamente in der Dosis reduziert werden. Unser besonderes Anliegen besteht in einem guten persönlichen Kontakt mit unseren Patienten: Daher legen wir großen Wert auf telefonische Rückfrage bei etwaigen interessierten Fragen oder Problemen.
Ergebnisse
An unserem Zentrum wurden von 1974 bis 2016 über 4.000 Nierentransplantationen durchgeführt. Die „Haltbarkeit“ von Nierentransplantaten ist heutzutage sehr gut. Etwas besser als in den internationalen Statistiken liegt unsere 10-Jahres-Nierentransplantat-Überlebensrate bei 75 %. Jene Transplantate, die langfristig ihre Funktion einstellen, erleiden in den meisten Fällen eine sogenannte „chronische Abstoßungsreaktion“, die weniger eine immunologische Abwehrreaktion darstellt, sondern eine Summe von chronischen Nierengewebs-/Gefäßveränderungen, die schließlich zu einer schlechten Nierendurchblutung und Vernarbung von Nierengewebe führen und somit die Filterleistung beeinträchtigen. Man kann mit einer derartigen Störung jedoch mehrere Jahre ohne Rückkehr zur Dialyse leben. Im Falle eines Transplantatverlustes wird eine zweite oder dritte Nierentransplantation angestrebt, welche technisch gut möglich ist, falls die klinischen Voraussetzungen entsprechend den oben erwähnten Voruntersuchungen für eine neue Transplantation entsprechen, wobei eine erhöhte Abwehrbereitschaft des Empfängers gegen die neue Niere zu erwarten ist.
Lebertransplantation
Die Notwendigkeit zur Lebertransplantation ergibt sich in vielen Fällen einer fortgeschrittenen Lebererkrankung nach Ausschöpfung der nicht operativen Therapiemöglichkeiten. Grundsätzlich kommt eine Lebertransplantation bei Patienten mit Lebergewebserkrankungen, Erkrankungen der Gallenwege, bestimmten Stoffwechselerkrankungen, ausgewählten Lebertumoren, akutem Leberversagen und anderen, selteneren Ursachen in Frage.
Die Entscheidung zur Listung für eine Lebertransplantation wird gemeinsam mit dem zuweisenden Hepatologen und unseren Kollegen an der Univ. Klinik für Innere Medizin I (Leiter: Univ. Prof. Dr. Herbert Tilg) getroffen. In jedem Fall wird für einen Patienten die individuelle Situation gemeinsam besprochen und die Entscheidung zur Transplantation in einem gemeinsamen Gremium gefällt. Der Zeitpunkt der Listung ist in Abhängigkeit von der Leberfunktion aber auch dem Fortschreiten der zugrundeliegenden Erkrankung und dem allgemeinen Zustand des Patienten zu treffen. Kriterien, welche bei der Entscheidungsfindung berücksichtigt werden sind neben der Leberfunktion auch das Vorhandensein von Aszites („Bauchwasser“), Bauchfellentzündungen, Bewusstseinsstörung, körperliche Schwäche, Leistungsknick bzw. zunehmende Müdigkeit, Blutungen in Magen oder Speiseröhre, der Typ, die Größe und das Wiederauftreten eines Tumors sowie eine durch die Lebererkrankung bedingte Nierenfunktionsstörungen.
Es ist wichtig einen Patienten nicht zu spät für eine Transplantation zu listen, da die Ergebnisse nach der Transplantation auch abhängig sind vom allgemeinen Zustand des Patienten vor der Transplantation.
Zur Beurteilung des Schwertgrades der Lebertransplantation dient wird der sogenannte MELD-Score (Model for End stage Liver Disease) herangezogen. Der MELD Score signalisiert den Schwertgrad der Lebererkrankung.
Liste an Lebererkrankungen bei denen eine Lebertransplantation in Frage kommt:
• Leberparenchymerkrankungen
Zirrhose durch Hepatitis B oder C, Zirrhose durch Autoimmunhepatitis, Fettleberzirrhose, Zirrhose unklarer Ursache
• Cholestatische Lebererkrankungen
Primär biliäre Zirrhose (PBC), Sekundär biliäre Zirrhose, Primär sklerosierende Cholangitis (PSC), Sekundär sklerosierende Cholangitis (SSC), Extrahepatische Gallengangsatresie, Progressive familiäre intrahepatsiche Cholestase (Morbus Byler), Aalagille-Syndrom, Kongenitale Fibrosen, Graft-versus-Host-Disease (GvHD), Chronische Abstoßung, Cholestatisch verlaufende Sarkoidose, Medikamentös-toxische Cholestase, Caroli-Syndrom
• Primäre Stoffwechselerkrankungen
a1-Antitrypsinmangel, Morbus Wilson, Hämochromatose, Tyrosinämie, Galaktosämie, Glykogen-Speicherkrankheiten, Lysosomale Speicherkrankheiten, Crigler-Najjar Typ I, Primäre Hyperoxalurie Typ I, Erythropoetische Protoporphyrie, Primäre Blutungsstörungen (ggf. mit Budd-Chiari-Syndrom), Störungen des Harnstoffzyklus (z.B. Citrullinämie), familiäre Amyloidose
• Sekundäre Stoffwechselerkrankungen
bei Kurzdarmsyndrom
• Akutes Leberversagen
Fulminante Virushepatitis (Hepatitis A,B,C,D,E), Intoxikationen, Amanita phalloides (Knollenblätterpilz),Paracetamol (Acetaminophen), Halothan, Tetrachlorkohlenstoff,, Ecstasy u.a., akute Schwangerschaftsfettleber, HELLP-Syndrom, Budd Chiari Syndrom, primäre Nichtfunktion einer transplantierten Leber
• Tumore
Hepatozelluläres Karzinom, Neuroendokrine Tumore (strenge Indikationsstellung), Hepatoblastom, Cholangiozelluläres Karzinom (strenge Indikationsstellung), Lebermetastasen eines Kolorektalen Karzinoms (strenge Indikationsstellung)
• Andere Ursachen
multiple Leberzysten, Folgen eines schweren Lebertraumas
Geschichte
Die erste Lebertransplantation am Menschen wurde 1963 von T.E. Starzl in Denver/USA durchgeführt. Seither gab es eine Reihe von Verbesserungen in der Diagnostik, der chirurgischen Technik, der Organkonservierung, der Unterdrückung der Immunantwort ebenso wie der Behandlung von Komplikationen nach der Transplantation. An der Medizinischen Universität Innsbruck wurde die Lebertransplantation von em. Prof. Dr. h.c. Raimund Margreiter etabliert. Unter seiner Leitung wurden über 1000 Lebertransplantationen durchgeführt und komplexe Formen der Transplantation wie die Transplantation von Leberteilen, die Transplantation mittels Lebendspende und die Kinderlebertransplantation etabliert. Heute ist die Lebertransplantation Therapie der Wahl bei einer Vielzahl fortgeschrittener Lebererkrankungen. Die Mehrzahl der Lebertransplantationen wird nach Entfernung der kranken Leber unter Verwendung von Leichenorganen durchgeführt. Alternativ kann eine Lebertransplantation im Rahmen einer “Lebendspende“ durchgeführt werden. Hierbei wird ein Teil der Leber eines gesunden Spenders dem kranken Empfänger übertragen. Insbesondere bei Kleinkindern hat sich dieses Verfahren bewährt (siehe auch Kinderlebertransplantation).
Organzuteilung
Die Zuteilung der Organe in der Transplantation stützen sich grundsätzlich auf zwei Pfeiler: Gerechtigkeit (Equity) und Nutzwert (Utility). Alle für eine Lebertransplantation gelisteten Patienten haben das gleiche Recht auf eine Transplantation, die Dringlichkeit und das Übereinstimmen zwischen Spender und Empfänger müssen bei der Auswahl berücksichtigt werden.
Um diesen beiden Grundwerten gerecht zu werden, werden erfolgt die Verteilung der Organe in vielen Ländern inklusive USA, Deutschland, Frankreich, Italien und Schweiz auf Basis des Model For End-Stage Liver Disease (MELD) Punktesystems. Dabei werden Kreatinin- und Gesamtbilirubinwerte im Blut, sowie der INR (International Normalized Ratio) berücksichtigt um den Schweregrad einer Lebererkrankung abzuschätzen. Beim Leberzelltumor (hepatozelluläres Karzinom) spiegelt der MELD-Wert nur eingeschränkt das Risiko durch die Erkrankung wider. Aus diesem Grund kann bei der Listung ein “exceptional MELD” von 22 Punkten angewendet werden, wenn der Tumor innerhalb einer definierten Größe ist (Milan-Kriterien).
Die Organzuteilung an der Medizinischen Universität Innsbruck basiert in erster Linie auf dem MELD-Wert und dem damit ausgedrückten Schweregrad der Erkrankung. Es werden aber für die Entscheidung auch weitere, im MELD System nicht abgebildete Faktoren berücksichtigt, welche ebenfalls für das Ergebnis eine große Rolle spielen berücksichtigt:
Die Wartezeit ist für den Patienten belastend und signalisiert wie lange der Patient schon an einer so schweren Erkrankung leidet. Vor allem bei Patienten mit sehr ähnlichem MELD wird die Wartezeit bei der Entscheidung berücksichtigt.
Bei der Entscheidungsfindung werden weiters berücksichtigt:
- Die Übereinstimmung von Größe und Alter und Gewicht
- Eignung des Organs für eine “komplexe” Transplantation, beispielsweise bei Vorliegen eines Gefäßverschlusses (z.B. Pfortaderthrombose), oder einer Retransplantation
- Eignung des Organs für einen kindlichen Empfänger
- Distanz zum Zentrum bei kurzem Zeitfenster
- Geschwindigkeit des Fortschreitens der Erkrankung
- Lebertransplantation im Rahmen einer simultanen Transplantation mehrer Organe
Die Zuteilung der Organe wird dokumentiert und jährlich von eine Delegation des Gesundheitsministeriums gemeinsam mit Vertretern der österreichischen Transplantationszentren geprüft.
Operationstechnik
Die Lebertransplantation ist heute eine etablierte Operation nach einem gut standardisiertes Verfahren. Nach Eröffnung des Bauchraumes wird die Leber freigelegt. Anschließend werden Gefäße und Gallenwege dargestellt, die Leberarterie und der Gallengang werden durchtrennt, die Pfortader vorläufig belassen. Nun wird die untere Hohlvene oberhalb und unterhalb der Leber angeschlungen und die Leber vollständig freigelegt. Es erfolgt nach Klemmen und Durchtrennung der Hohlvene und der Pfortader die Entfernung der Leber. Nun wird die neue Leber in den Bauchraum platziert und die Gefäße des Empfängers mit denen des Spenderorganes verbunden (Hohlvene, Pfortader, Leberarterie). Nach Fertigstellung der Gefäßverbindungen wird der Blutfluss wiederhergestellt, die Leber beginnt nun ihre Funktion aufzunehmen. Zum Abschluss wird der Gallengang wiederhergestellt durch Verbindung desselben mit dem Empfängergallengang oder mit einer Dünndarmschlinge. Zum Abschluss werden Drainagen zur Ableitung des entstehenden Sekrets eingelegt und der Bauch verschlossen. Die durchschnittliche Operationsdauer einer Lebertransplantation beträgt 4-6 Stunden. Nach der Operation kommen die Patienten zur Überwachung auf die Intensivstation, meist schon nach wenigen Tagen auf die transplantationschirurgische Normalstation, wo sie von speziell ausgebildeten Pflegekräften betreut werden. Der stationäre Aufenthalt nach Lebertransplantation beträgt 2-3 Wochen.
Lebertransplantation bei Kindern
Valeria
Immunsuppression
Das Immunsystem erkennt ein transplantiertes Organ als fremd. Um eine Abstoßung des transplantierten Organes zu verhindern, muss eine medikamentöse Unterdrückung des Immunsystems durchgeführt werden. Eine Reihe von Medikamenten steht dafür zur Verfügung. Entscheidend ist, die richtige Auswahl und die richtige Menge an Medikamenten einzusetzen. Wird das Immunsystem des Organempfängers zu wenig unterdrückt, kommt es zu einer Abstoßungsreaktion, ist die Dosierung der Immunsuppressiva jedoch zu hoch, besteht ein hohes Risiko für Infektionen und Tumorerkrankungen. In der Regel wird eine Immunsuppression mit drei Substanzen durchgeführt. Eine Kombination von 1) Kalzineurinhemmern (Tacrolimus oder Cyclosporin-A), 2) einem Hemmer der Zellteilung (Mycophenolsäure, mTOR-Hemmer, Azathioprin) und 3) Kortison haben sich bewährt. Diese Medikamente sind eine Langzeit-Dauertherapie, deren Dosis jedoch längerfristig deutlich reduziert werden kann, sodass unter dieser Medikation eine gute Lebensqualität und körperliche Leistungsfähigkeit möglich ist. In manchen Fällen wird zur Einleitung der Immunsuppression bei oder kurz nach der Transplantation ein Antikörper verabreicht, der die Zahl der Immunzellen im Empfänger verringern soll. In den Monaten und Jahren nach der Transplantation wird immer wieder eine Anpassung der Immunosuppression notwendig. Die langfristige Betreuung und damit auch die Anpassung der medikamentösen Behandlung wird von ihrem Hepatologen durchgeführt. Entscheiden ist, dass wesentliche Änderungen in der Behandlung mit uns oder unseren Kollegen an der Univ. Klinik für Innere Medizin I (Leiter: Univ. Prof. Dr. Herbert Tilg) abgesprochen werden.
Nebenwirkungen der Immunosuppression
Leider ist die Verwendung der Medikamente zur Verhinderung der Abstoßung oft mit dem Auftreten von Nebenwirkungen verbunden. Typische Nebenwirkungen sind: Nierenfunktionseinschränkung, Kopfschmerzen, Zittern, Durchfälle, erhöhte Blutfette, Magengeschwüre und Osteoporose. Durch eine Dosisreduktion oder den Wechsel auf ein anderes Medikament können unerwünschte Nebenwirkungen jedoch meist beseitigen oder zumindest verringern werden. Aufgrund der künstlich unterdrückten Abwehrreaktion des Körpers ist insbesondere in der ersten Phase nach der Transplantation mit einem erhöhten Infektionsrisiko zu rechnen. In den ersten zwei Monaten nach der Transplantation sollten zusätzliche Risiken für eine Infektion vermieden werden: abzuraten ist in dieser Phase von größeren Menschenansammlungen, unmittelbarem Kontakt mit infektiösen Personen oder starker Staub- und Schmutzexposition. Im Verlauf der nachfolgenden Monate wird dieses Risiko kleiner, da die genannten Medikamente in der Dosis reduziert werden.
Ergebnisse
Am Transplantationszentrum Innsbruck wurden seit 1977 über 1500 Lebertransplantationen durchgeführt. Das 1-Jahres Patientenüberleben nach Lebertransplantation liegt an unserem Zentrum bei 90-95%, das 5-Jahres-Überleben bei 70-80%. Über 50 Transplantationen erfolgten dabei als Lebendspende-Lebertransplantation bei Erwachsenen oder Kindern. Mehr als 120 Transplantationen bei Kindern wurden in unserem Zentrum durchgeführt. Bei schweren Formen der Transplantatabstoßungen, die nicht durch Medikamente behandelbar sind, oder bei schweren sonst nicht beherrschbaren Gefäß- bzw. Gallengangskomplikationen kann eine neuerliche Lebertransplantation notwendig werden.
Pankreastransplantation
Im Jahre 1966 wurde in den USA die erste Pankreastransplantation durchgeführt. Seither hat sich diese Operation von einem experimentellen Ansatz zu einer standardisierten und anerkannten Therapieoption für Patienten, die unter insulinpflichtigem Diabetes Mellitus (Blutzuckerkrankheit) leiden, entwickelt. Die laufenden Fortschritte und Veresserungen der chirurgischen Technik, der Organpräservation, der Immunosuppression und auch der Prävention und Behandlung infektiologischer Komplikationen haben dazu geführt, dass heutzutage die kombinierte Nieren-Pankreas-Transplantation bei dialysepflichtigen, insulinabhängigen Diabetikern die Therapie der Wahl darstellt. Ziel der Pankreastransplantation ist es, die fehlende Insulinproduktion durch das neu eingepflanzte Organ zu ersetzen, und somit durch eine kontinuierliche, beinahe physiologische Insulinausschüttung einen Blutzuckerspiegel im Normbereich zu erreichen. Neben der deutlichen Anhebung der Lebensqualität, die mit einer erfolgreichen Transplantation einhergeht, zeigen Langzeitergebnisse durch ein vermindertes Voranschreiten oder sogar durch einen Rückgang von Begleiterkrankungen auch eine Verlängerung der mittleren Lebenserwartung.
An der Universitätsklinik für Visceral-, Transplantations- und Thoraxchirurgie wurden in den Jahren von 1979 bis 2016 über 590 Pankreastransplantationen durchgeführt, wodurch das Innsbrucker Transplantationszentrum auf diesem Gebiet europaweit zu den erfahrensten zählt.
Indikation
Nach dem heutigen Wissensstand stellt die kombinierte Nieren-Pankreas-Transplantation für insulinpflichtige Patienten mit terminaler Niereninsuffizienz die Therapie der Wahl dar. Abgesehen von der deutlichen Verbesserung der Lebensqualität, die mit einer erfolgreichen Transplantation einhergeht, beobachtet man auch eine Stabilisierung oder einen Rückgang der diabetesbedingten Komplikationen (Gefäßerkrankung, Neuropathien). Weiters wird durch die kombinierte Transplantation beider Organe ein Wiederauftreten der diabetischen Nierenerkrankung verhindert. Der Vorteil einer kombinierten Nieren-Pankreas-Transplantation wird durch die Langzeitergebnisse bestätigt. Die mittlere Lebenserwartung eines insulin- und dialysepflichtigen Patienten ohne Transplantation beträgt 8 Jahre. Durch eine Nierentransplantation wird diese auf 13 Jahre verlängert, während eine erfolgreiche kombinierte Nieren-Pankreas-Transplantation die mittlere Lebenserwartung sogar auf 23 Jahre anhebt. Unabhängig vom Typ des Diabetes Mellitus werden nur Patienten gelistet, die täglich Insulin spritzen müssen und dialysepflichtig sind oder eine derart eingeschränkte Nierenfunktion haben, dass eine Dialyse kurz bevorsteht. Die obere Altersgrenze wird bei 55 – 60 Jahren gesetzt, da das Übergewicht ein Risiko für die Transplantation darstellt, ist ein body mass index (BMI, Relation aus Körpergewicht und Größe) unter 35 Voraussetzung. Alleinige Pankreastransplantationen werden ebenso durchgeführt. Dies ist bei insulinpflichtigen Patienten indiziert, die tiefe Blutzuckerspeigel nicht wahrnehmen (hypoglycemia unawareness) oder trotz regelmäßiger Insulinzufuhr stark schwankende Blutzuckerwerte aufweisen (Brittle Diabetes). Beide Erkrankungen stellen lebensbedrohliche Situationen dar. Weitere Indikationen für alleinige Pankreastransplantationen sind Patienten, die bereits eine alleinige Nierentransplantation erhalten haben oder Patienten mit einem Pankreastransplantatfunktionsverlust.
Operative Technik
Nach der Entnahme sollte das Organ so früh wie möglich dem Empfänger implantiert werden, um die Schädigung des Organs so gering wie möglich zu halten. Üblicherweise wird das gesamte Organ mit einen Teil des Zwölffingerdarms implantiert. Die Implantation wird über einen Schnitt in der Mitte des Bauches durchgeführt. Das Pankreastransplantat wird an eine Arterie im rechten Unterbauch und an die untere Hohlvene oder an eine Mesenterialvene angeschlossen. Der Zwölffingerdarm wird ca. 60cm unterhalb des Magenausgangs mit dem Empfängerdünndarm verbunden. Diese Technik ermöglicht eine spätere Transplantatbeurteilung und -probenentnahme mittels einer Magen-Dünndarmspiegelung. Die Niere wird bei der kombinierten Nieren-Pankreas-Transplantation an die linken Beckengefäße (Arterie und Vene) angeschlossen. Der Harnleiter wird in die Blase eingenäht. Bei Funktionsverlust des Pankreastransplantates ist auch eine neuerliche Pankreastransplantation möglich. Frühzeitige Pankreastransplantatverluste werden in 5% – 10% beobachtet, wobei die häufigsten Ursachen Verschlüsse der Transplantatgefäße, Infektionen im Bauchraum und die Transplantatpankreatitis sind.
Die Immunosuppression (Unterdrückung der Immunantwort) besteht bei der Pankreastransplantation üblicherweise aus einer Dreifach – Erhaltungstherapie (Kortison, Kalzineurin-Hemmer, Mycophenolatmofetilsäure), kombiniert mit einer anfänglichen „Induktionstherapie“ mittels eines Antikörpern, die gegen T-Lymphozyten gerichtet sind. Im weiteren Verlauf wird die Kortisondosis verringert, mit dem Ziel es nach 6 bis 12 Monaten absetzen zu können. Auch die restlichen Immunosuppressiva werden von dem behandelnden Arzt so weit reduziert und somit „maßgeschneidert“, dass über die Jahre einerseits eine Abstoßung verhindert wird und andererseits unerwünschte Nebenwirkungen minimiert werden. Nierenfunktionseinschränkung, Kopfschmerzen, Zittern, Durchfälle, erhöhte Blutfette, Magengeschwüre und Osteoporose zählen zu den häufigsten Nebenwirkungen. Dank einer immer breiter werdenden Palette von Immunosuppressiva gelingt es jedoch zumeist, durch Dosisreduktion oder den Wechsel auf ein anderes Medikament unerwünschte Nebenwirkungen zu beseitigen oder zu verringern. Aufgrund der starken Immunogenität des Pankreastransplantates sind die Dosierungen höher als z.B. bei Leberempfängern. Weiters zwingen Schwankungen der Medikamentaufnahme durch den Darm und die unterschiedliche „Abstoßungs-Bereitschaft“ der Empfänger zu individuelle Therapien, die im Rahmen der regelmäßigen Nachsorge nach Absprache mit dem behandelnden Arzt optimiert werden. Die langjährige enge und gute Zusammenarbeit mit den zuweisenden Internisten ermöglicht es den Patienten, die Nachsorgekontrollen im Heimatkrankenhaus durchzuführen. Nach Erhalt der Laborbefunde und der Untersuchungsergebnisse werden eventuelle Therapieänderungen nach Rücksprache mit unserem Transplantationszentrum durchgeführt. Selbstverständlich ist es auch möglich, die Nachsorge an unserem Zentrum durchzuführen. Bei Verdacht auf eine Abstoßung kann deren Ausmaß mittels einer Magen-Dünndarmspiegelung beurteilt werden, indem eine Gewebeprobe des mittransplantierten Zwölffingerdarmes entnommen und untersucht wird. Anhand des vorliegenden Ergebnisses wird die weitere Therapie festgelegt. Alternativ kann eine Biopsie der transplantierten Niere entnommen werden, da bei einer Abstoßung meistens beide Organe davon betroffen sind.
Ergebnisse
Das International Pancreas Transplantation Registry (IPTR) sammelt weltweit die Ergebnisse der Pankreastransplantat-Empfänger. Der aktuelle Stand gibt ein 3-Jahres-Patientenüberleben von über 90% an. Je nach Art der Transplantation schwankt das 3-Jahres-Pankreastransplantatüberleben zwischen 60% (alleinige Pankreastransplantation) und 80% (kombinierte Nieren-Pankreas-Transplantation). Mit über 95% 3-Jahres-Patientenüberleben und knapp 90% 3-Jahres-Pankreastransplantatüberleben bei kombinierten Nieren-Pankreas-Transplantationen liegen die Ergebnisse an unserer Klinik über dem internationalen Durchschnitt.Gute Langzeitergebnisse können auch mit Pankreas-retransplantationen erreicht werden. Die 3-Jahres Transplantat- und 3-Jahres-Patientenüberlebensraten betragen jeweils 60% und 85%.
Dünndarm- und Multiviszeraltransplantation
Die Dünndarmtransplantation, d.h. der Ersatz des körpereigenen Dünndarmes durch einen Spenderdünndarm eines verstorbenen Spenders oder eines Lebendspenders, ist die einzige kausale Therapie des Kurzdarmsyndromes. Sie stellt ein Alternativverfahren zur künstlichen Ernährung dar, und ist dann die Therapie der Wahl, wenn Komplikationen der künstlichen Ernährung (schwerwiegende Leberfunktionsstörung, Venen-Katheter-bedingte Infektionen, Verlust der venösen Zugangsmöglichkeiten) eingetreten sind. Ist es durch die künstliche Ernährung bereits zu einer irreversiblen Schädigung der Leber gekommen, wird eine kombinierte Dünndarm-Leber-Transplantation durchgeführt. Unter Multiviszeraltransplantation versteht man den Ersatz von mehreren Bauchorganen (Leber, Magen, Zwölffingerdarm, Dünndarm, Dickdarm, Bauchspeicheldrüse, Nieren). Die erste Dünndarmtransplantation am Menschen erfolgte 1967 (University of Minneapolis). 1989 wurde von Prof. Raimund Margreiter an unserer Klinik die weltweit erste erfolgreiche Multiviszeraltransplantation bei einem Erwachsenen durchgeführt.
Indikation
Die Dünndarmtransplantation stellt die einzige kurative Therapie für Patienten mit Kurzdarmsyndrom und der Notwendigkeit einer lebenslangen künstlichen intravenösen Ernährung dar. Verschiedene Erkrankungen können zum Kurzdarmsyndrom führen. Weitere Indikationen stellen funktionelle Störungen des Dünndarmes dar. Hier kommt es durch eine gestörte Funktion des Dünndarms zur Notwendigkeit der künstlichen Ernährung. Eine kombinierte Dünndarm-Lebertransplantation wird bei Patienten durchgeführt, bei denen bereits eine Zirrhose der Leber vorliegt. Eine Multivisceraltransplantation stellt eine gesonderte Indikation für Patienten mit Gardner Syndrom und Patienten mit infolge mehrerer durchgeführter Operationen stark vernarbtem Bauchraum dar.
Verschluss der den Darm versorgenden Gefäße, Volvulus, Verletzung/Unfall, Morbus Crohn, Nekrotisierende Enterokolitis, Atresie des Dünndarms, Gastroschisis, Pseudoobstruktion, Malabsorptionssyndrom, Myogene oder neurogene Funktionsstörungen
Operationstechnik
Nach Eröffnung des Bauchraumes werden zunächst sämtliche Verwachsungen gelöst. Bei funktionellen Störungen des Darmes wird dieser entfernt. Anschließend werden geeignete Blutgefäße für die Herstellung der Gefäßverbindungen aufgesucht und für die Transplantation freigelegt. Die arterielle Gefäßverbindung wird zumeist mit der Bauch-Aorta hergestellt, der venöse Anschluss erfolgt entweder über die untere Hohlvene oder die Pfortader/V. mesenterica superior. Nach Eröffnung des Blutflusses in das neue Organ wird nun eine Verbindung des Anfangs des Transplantat-Dünndarmes mit dem patienteneigenen verbliebenen Dünndarm hergestellt sowie eine Verbindung zum patienteneigenen Dickdarm, falls dieser noch vorhanden ist. Das Ende des Dünndarmes wird über einen künstlichen Darmausgang (Stoma) durch die Bauchdecke ausgeleitet. Zum Schluss wird die Bauchdecke verschlossen, in einigen Fällen ist hierzu eine vorübergehende Bauchwandplastik notwendig. Das Stoma kann, wenn der Dünndarm angenommen ist, mehrere Wochen nach der Transplantation rückverlagert werden. Multiviszeraltransplantation Nach Eröffnung des Bauchraumes werden zuerst alle Organe entfernt, die ersetzt werden sollen. Nun wird eine Geeignete Stelle auf der Bauch-Aorta für den arteriellen Gefäßanschluss aufgesucht und vorbereitet. Beide großen arteriellen Gefäße (Truncus coeliacus, A. mesenterica superior) werden gemeinsam mit einem Stück Spender-Aorta anastomosiert. Der venöse Ausfluss des Organpaketes wird durch Ersatz der unteren Hohlvene hergestellt. Nach Durchblutung des Organpaketes wird die Verbindung Zwischen Magen des Empfängers und des Spenders hergestellt. Zum Abschluss wird das Darmende mit dem Dickdarm verbunden und vorübergehend oder definitiv ausgeleitet (Stoma). Der Bauchdeckenverschluß erfolgt meist in mehreren Etappen. Das Stoma kann mehrere Wochen nach der Transplantation rückverlagert werden.
Immunosuppression
Um eine Abstoßung des transplantierten Darmes/Organpaketes zu verhindern, muss eine medikamentöse Unterdrückung des Immunsystems durchgeführt werden. Insbesondere für den Dünndarm besteht ein hohes Risiko für eine Abstoßung, daher wird im Vergleich zu anderen Organen eine höhere Immunsuppression durchgeführt. Neben der Kombination von Kalzineurinhemmer (Tacrolimus), ii) einem Hemmer der Zellteilung (Mycophenolsäure) und Kortison wird i.v.) wird routinemäßig ein Antikörper, der gegen immunreaktive T- Zellen gerichtet ist, in den ersten Tagen nach der Transplantation verabreicht. Häufig ist es notwendig, in den ersten Wochen nach der Transplantation die Immunsuppression mit hohen Dosen an Kortison und manchmal auch neuerlichen Anwendungen von Anti-T-Zell Antikörpern zu intensivieren. Bei der Immunsuppression handelt es sich um eine Langzeit-Dauertherapie, die Dosis der Immunsuppressiva kann jedoch längerfristig deutlich reduziert werden, sodass unter dieser Medikation eine gute Lebensqualität und körperliche Leistungsfähigkeit möglich ist.
Nebenwirkungen der Immunosuppression
Nierenfunktionseinschränkung, Kopfschmerzen, Zittern, Durchfälle, erhöhte Blutfette, Magengeschwüre und Osteoporose zählen zu den häufigsten Nebenwirkungen. Dank einer immer breiter werdenden Palette von Immunsuppressiva gelingt es jedoch zumeist, durch Dosisreduktion oder den Wechsel auf ein anderes Medikament unerwünschte Nebenwirkungen zu beseitigen oder zu verringern. Aufgrund der künstlich unterdrückten Abwehrlage ist insbesondere in der ersten Phase nach der Transplantation mit einem erhöhten Infektionsrisiko zu rechnen, worüber die Patienten in Vorgesprächen vor der Transplantation und während des stationären Aufenthaltes informiert und beraten werden. Man plant eine Entlassung nach der Transplantation dann, sobald der Patient sich infektiologisch sicher fühlen kann, wobei in den ersten zwei Monaten nach der Transplantation ein behutsamer Umgang mit potenziellen Infektionsquellen empfohlen wird: Abzuraten ist in dieser Phase von größeren Menschenansammlungen, unmittelbarem Kontakt mit infektiösen Personen oder starker Staub- und Schmutzexposition. Im Verlauf der nachfolgenden Monate wird dieses Risiko kleiner, da die genannten Medikamente in der Dosis reduziert werden. Zusätzlich zu dem erhöhten Infektionsrisiko besteht unter Immunsuppression ein etwas höheres Risiko, eine Tumorerkrankung zu erleiden. Bei Darm- und Multiviszeraltransplantationen kann es zusätzlich noch zu einer so-genannten Graft-versus-Host Reaktion kommen: hier richten sich die Immunzellen des Spenderorganes, die unweigerlich mittransplantiert werden, gegen die Organe des Empfängers, was sich insbesondere an den Zellen des blutbildenden Systems, an Schleimhäuten, Magen, Darm, Leber und der Haut manifestiert.
Ergebnisse
Weltweit wurden mehr als 1200 Darm-/Multiviszeraltransplantationen durchgeführt. Durch Verbesserungen in der Immunsuppression und der Verhinderung/Behandlung von Infektionen konnte das Langzeitüberleben der darmtransplantierten Patienten in den letzten zehn Jahren deutlich verbessert werden. Ein Jahr nach Transplantation sind der Großteil der Patienten nicht mehr auf zusätzliche künstliche intravenöse Ernährung angewiesen. Das 1-Jahres Überleben beträgt 80-90%, das 5-Jahres-Überleben 60-80%.
Handtransplantation
Mit der ersten erfolgreichen Handtransplantation bricht im September 1998 eine neue Ära in der Rekonstruktiven- ebenso wie in der Transplantationschirurgie an: neue, potente Medikamente machen erstmals die erfolgreiche Transplantation einer Hand, eines Kehlkopfs oder einer Bauchdecke möglich.
Seit der ersten Handtransplantation der „neuer Ära“ 1998 in Lyon, Frankreich, wurden weltweit bisher 33 weitere Transplantationen an 25 Patienten durchgeführt. Das Ein-Jahres Überleben von 100% bestätigte nicht nur die Machbarkeit dieses komplexen Eingriffs sondern auch ein optimales „Überleben“ der transplantierten Hände zumindest in der Frühphase nach der Transplantation. Es wurde bald auch klar, dass weniger der chirurgische Eingriff (eine Handtransplantation wird im Allgemeinen als technisch einfacher eingestuft als eine Replantation), sondern immunologische Faktoren sowie Medikamentennebenwirkungen und die aufwendige und langwierige Rehabilitation die Hürden für den langfristigen Therapieerfolg darstellen. Die Einrichtung des „International Registry on Hand and Composite Tissue Transplantation“ (www.handregistry.com) im Mai 2002 ermöglicht die Auswertung der Ergebnisse aller bisher durchgeführten Handtransplantationen. Insgesamt wurden 11 einseitige und 4 beidseitige Handtransplantationen durchgeführt. Alle Empfänger waren männlich, das durchschnittliche Alter zum Zeitpunkt der Transplantation betrug 32 Jahre. Unter der verwendeten immunosuppressiven Therapie sind innerhalb des ersten Jahres nach Transplantation 26 akute Abstoßungsreaktion (AR) beobachtet worden. Die AR ist also trotz der nicht geringen Immunosuppression ein häufiges Ereignis nach Handtransplantation. Gekennzeichnet ist diese durch ein Exanthem, welches unregelmäßig verteilt an einzelnen Stellen auftreten oder einen Großteil der Hand einnehmen kann. In den meisten Fällen konnte eine Abstoßung mittels Kortisonbolus-Therapie erfolgreich behandelt werden, bei wiederholt aufgetretenen Abstoßungsreaktionen wurde jedoch der Einsatz mono- oder Abstoßungsreaktionen Antikörper gegen Lymphozyten notwendig. Das Transplantatüberleben nach 32-87 Monaten (Durchschnitt: 60,4 Monate) beträgt 92%, das Patientenüberleben 100%. Zwei Hände wurden aufgrund einer Abstoßung wieder abgenommen, weiters ist es bei 11 Patienten nach einem Absetzen der Medikamente zu einem Verlust der Handfunktion gekommen.
An chirurgischen Komplikationen wurden zweimal Nekrosen kleiner Hautareale, eine arterielle Thrombose sowie bei einem Patienten das Auftreten von arteriovenösen Fistel beobachtet. All diese Komplikationen konnten durch kleine Korrektureingriffe behoben werden. Es hat sich gezeigt, dass die notwendige Immunosuppression (IS) in etwa vergleichbar mit der nach Bauchspeicheldrüsen- oder Herztransplantation ist. Nachteile der IS sind vor allem das erhöhte Risiko für Infektionen und Tumore. Neben Pilzinfektionen der Haut wurden besonders häufig Infektionen mit dem Cytomegalievirus beobachtet. Die Analyse der Handfunktion der bisher transplantierter Patienten zeigte, dass bei fast allen Patienten ein gutes Ergebnis erzielt werden konnte. Die Funktion der Unterarmmuskulatur erlaubt eine Greiffunktion bei allen transplantierten Händen. Die Greifkraft beträgt über 10 kg bei 4 Patienten, mehr als 5kg bei 8 Patienten, mehr als 2,5kg bei 3 und weniger als 2,5kg bei 2 Patienten. Die Fingerkraft beträgt mehr als 2kg bei 4 Patienten, mehr als 1kg bei 7 Patienten, mehr als 0,5kg bei 2 und weniger als 0,5kg ebenfalls bei 2 Patienten. Alle Patienten entwickelten eine Schutz- und die meisten Patienten außerdem eine gute Oberflächensensibilität (Highet Scale modifiziert nach Dellon). Insgesamt wurde die Sensibilität bei 5 Händen als ausgezeichnet, bei 2 als gut und bei 10 als zufriedenstellend bewertet. Bei 4 Händen war keine Oberflächensensibilität nachweisbar. Noch unklar ist allerdings, ob die gute Funktion langfristig durch eine chronische Abstoßung bedroht ist. Auswertungen funktioneller sowie feingeweblicher sowie bildgebender Analysen ergaben bisher keinen Hinweis auf eine chronische Abstoßung, dennoch kann langfristig das Risiko des Auftretens einer solchen Veränderung nicht sicher ausgeschlossen werden.
Allgemeine Voraussetzungen
Eine Handtransplantation ist eine langfristige und komplexe Therapieoption. Neben dem chirurgischen Eingriff sind die Durchführung einer intensiven physikalischen Therapie sowie die regelmäßige Einnahme von Medikamenten zur Verhinderung einer Abstoßungsreaktion notwendig. Nach einer aufwendigen Abklärung dauert die Wartezeit bis zur Operation bis zu zwei Jahren. Der genaue Zeitpunkt ist vom Vorhandensein eines geeigneten Spenders abhängig und kann deshalb nicht vorhergesagt werden. Die Phase der intensiven Nachbehandlung erstreckt sich auf ein Jahr, und eine Verbesserung der funktioneller Ergebnisse schreitet nach bisherigen Erfahrungen bis zu fünf Jahre nach der Operation fort. Neben einer allgemeinen Narkosetauglichkeit ist daher auch eine stabiler gesundheitlicher Zustand erforderlich.
Psychische Voraussetzungen
Eine Handtransplantation stellt enorme Anforderungen an die Psyche eines Patienten: Vom ersten Tag an sowie insbesondere im ersten Jahr nach der Operation muss der Patient konsequent den eingeschlagenen Weg verfolgen. Bereits vor der Operation sind regelmäßig Übungen zum Training der Unterarmmuskulatur durchzuführen. Und nach der Transplantation ist mit einem Einsetzen der Beweglichkeit sowie des Berührungsempfindens an den Händen erst nach Monaten härtester Arbeit zu rechnen. Zudem kann auch zunehmender Erfahrung im Bereich der Handtransplantation das genaue Ausmaß der zu Erreichenden Funktion nicht genau vorhergesagt werden. Soweit bisher ersichtlich scheint aber in jedem Fall eine Steigerung gegenüber den besten Ergebnissen einer Versorgung mit mechanischen Prothesen erzielbar zu sein. Wie bei jeder Transplantation ist der Langzeiterfolg zu 100% von der Mitarbeit des Patienten, insbesondere dem täglichen Training und der konsequentesten Befolgung der Anweisungen der behandelnden Ärzte, vor allem aber auch der Einnahme der immunosuppressiven Medikamente betreffend, abhängig.
Chirurgische Voraussetzungen
Um eine akzeptable Funktion nach Handtransplantation erwarten zu können ist ein guter Zustand des Amputationsstumpfes erforderlich. Dies beinhaltet wesentlich die Länge des Unterarmstumpfes, welche prinzipiell so lange wie möglich, in jedem Fall aber ein Viertel bis Drittel der ursprünglichen Unterarmlänge betragen sollte. Hierbei ist insbesondere der Zustand der Unterarmmuskulatur sowie der versorgenden Nerven entscheidend, da diese Strukturen ja im Zuge der Transplantation „angeschlossen“ werden müssen. Von neurologischer Seite ist die Intaktheit der Nerven bis hin zum Amputationsstumpf unerlässlich.
Logistik und Finanzierbarkeit
Obwohl in der Vergangenheit jedes Mal relevante finanzielle Hilfe auch von Seiten der Medizinischen Universität Innsbruck sowie der TILAK erfolgte, ist auf Grund des mehrjährigen Engagements eine Zusage seitens der Versicherung des Patienten erforderlich. Dies gilt in besonderem Maße auch für eine Zusage der Kosten einer mehrjährigen Nachbehandlung sowie einer lebenslangen immunosuppressiven Therapie (nach einem ausschließlich von der Medizinischen Universität Innsbruck festzulegendem Schema). Von Seiten der Wohnsituation sollte eine akzeptable, jedoch wohl im Einzelfall zu klärende Nähe zu der Medizinischen Universität Innsbruck bestehen.
Patientenauswahl
Eine Handtransplantation ist eine mögliche Therapie für einen Patienten (siehe Voraussetzungen zur Handtransplantation) mit Amputation der Hand sowie Teilen des Unterarms. Eine weitere Vorraussetzung ist die Intaktheit des Unterarmstumpfes. Primär gilt an der Medizinischen Universität Innsbruck nur die beidseitige Unterarmamputation als etablierte Indikation für eine Transplantation. Jedoch werden auch Patienten mit einseitiger Amputation gerne über eine Handtransplantation informiert und in Einzelfällen können auch diese Patienten transplantiert werden. In jedem Fall sollte der Patient die Versorgung mit einer myoelektrischen Prothese versucht haben. Eine Handtransplantation ist dann vor allem für Patienten eine Option, die mit einer solchen Prothese unzufrieden sind und weiter unter dem Verlust der Hände/Hand leiden. Für die Selektion von Kandidaten, die für eine Handtransplantation in Frage kommen, wurden in Innsbruck spezifische Kriterien definiert: Das erste und wichtigste Kriterium ist der unbedingte Therapiewunsch des Patienten. Nach ausführlicher Aufklärung nicht nur über die Operation, sondern insbesondere auch über die notwendige Physio- und Ergotherapie im Rahmen der Rehabilitation sowie die Notwendigkeit einer immunosuppressiven Dauertherapie und den damit verbundenen Risiken wird den Kandidaten ausreichend Zeit für eine endgültige Entscheidung gegeben. Als anatomische Vorraussetzungen galten der Verlust beider Hände bzw. Unterarme, als Altersgrenzen 18 bzw. 55 Jahre. Die Kandidaten mussten in gutem physischen und psychischen Zustand und frei von Stoffwechselerkrankungen, Infekten sowie Tumoren sein. Die Untersuchung der Amputationsstümpfe erfolgte mittels Röntgen, Ultraschall, Computertomographie, Magnetresonanztomographie, Angiographie und CT-Angiographie. Zum Ausschluss eines Malignoms sowie eines Infektherdes wurden neben entsprechenden Blutanalysen Untersuchungen des Magen-Darm Traktes, des Urogenitaltrakts, der Zähne, des Rachens sowie der Nasennebenhöhlen durchgeführt.
Die physikalische Therapie wurde so konzipiert, dass eine rasche Rehabilitation unterstützt, Schwellung und Schmerzen gemindert sowie die Versteifung der Gelenke verhindern werden sollten. “Early Protective Motion – EPM” ist ein Therapiekonzept, das schon nach Handreplantation mit gutem Erfolg eingesetzt worden war, das die oben genannten Kriterien erfüllt und deshalb auch nach Handtransplantation angewandt wurde. Besonderes Augenmerk wurde weiters auf das Wiedererlangen der Sensibilität und die Reintegration der Hand in das zentrale Nervensystems gelegt. Zu diesem Zweck wurden kognitive Übungen nach Perfetti zum zentralen Bestandteil der Rehabilitation. Ergänzt wurde die Rehabilitation durch ergotherapeutische Übungen zur Bewältigung von Tätigkeiten des täglichen Lebens. Begonnen wurde mit passiven Übungen am dritten Tag nach Transplantation. Ab der dritten Woche wurde die Muskulatur innerhalb der Hand durch Elektrostimulation aktiviert und eine Woche später wurde mit aktiven Fingerübungen begonnen. Ab der neunten Woche wurde die Therapie durch ein elektromyographisches Feedback-Training erweitert. Verschieden geformte Schienen wurden zum Schutz der Hände sowie zur Stabilisierung des Handgelenks eingesetzt. Ein ähnliches Protokoll kam nach Unterarmtransplantation zur Anwendung. Da sich dieser Eingriff jedoch ganz wesentlich von dem ersten Eingriff unterschieden hatte, wurde das Rehabilitationsprogramm der klinischen Situation entsprechend angepasst.
Ergebnisse
Die erste Handtransplantation in Innsbruck wurde im März 2000 durchgeführt, fünf Jahre und sechs Monate nach Amputation der Hände. Die Rekonstruktion erfolgte in folgender Reihenfolge: Knochen, Arterien, Venen, Sehnen der Flexoren, Sehnen der Extensoren, Nerven und schließlich Haut. Der chirurgische Eingriff beim zweiten Patient erfolgte im Februar 2003. Da die Amputation auf Höhe des oberen Unterarms erfolgt war, konnte die wenige verbliebene Unterarmmuskulatur nicht für die Rekonstruktion verwendet werden. Es wurde daher die Unterarmmuskulatur des Spenders am Oberarmknochen des Empfängers fixiert. Es war die erste Transplantation dieser Art weltweit. Die dritte Transplantation erfolge im Mai 2006. Der Eingriff verlief ebenso wie die beiden vorangegangenen Operationen ohne große Komplikation. Beide operativen Eingriffe wurden von Mitgliedern der Klinik für Plastische- und Wiederherstellungschirurgie gemeinsam mit dem handchirurgischen Team der Universitätsklinik für Unfallchirurgie durchgeführt.Patientenzufriedenheit. Neben objektivierbaren Kriterien wie Motorik oder Sensibilität spielen auch subjektive Aspekte wie z.B. die Fähigkeit zur sozialen Interaktion oder ein ganzheitliches Körperempfinden nach Handtransplantation eine wesentliche Rolle für die Zufriedenheit des Patienten. Die Messbarkeit und Vergleichbarkeit von solchen Aktivitäten, Empfindungen und Eindrücken ist limitiert. Deshalb ist die Meinung des Patienten darüber, ob und wie die Handtransplantation das eigene Leben verändert hat, von ausschlaggebender Bedeutung. Außerdem entspricht jede Auswertung einer Momentaufnahme, womit der Zeitpunkt der Erhebung von Bedeutung ist. Wie oben erwähnt, ist die motorische Funktion nach Handtransplantation derjenigen einer myoelektrischen Prothese deutlich überlegen, insbesondere zusammengesetzte Bewegungen sowie die feinmotorische Steuerung der Bewegungen fallen dem Patienten leichter. Von besonderer Bedeutung ist für beide Patienten das Wiedererlangen der körperlichen Integrität, die ihnen von den Prothesen nicht vermittelt worden war. Dadurch hat sich die Fähigkeit zur sozialen Interaktion sowie zu Intimkontakten deutlich gebessert. Insgesamt sind beide Patienten sehr zufrieden sowohl mit dem funktionellem als auch dem kosmetischen Ergebnis. Bei den beschriebenen Patienten ist zwar die motorische Funktion nach Handtransplantation besser als jene nach Unterarmtransplantation, jedoch ist diese weiterhin zunehmend und der Beobachtungszeitraum beim zweiten Patienten deutlich kürzer als beim ersten Patienten. Insgesamt beträgt die erreichte Funktion nach Handtransplantation >60% einer normalen Hand. Zusammen mit der sehr guten Sensibilität ohne Kälteintoleranz ermöglicht die erzielte Funktion dem Patienten zahlreiche Aktivitäten durchzuführen, die er mit den Prothesen nicht bewältigen konnte. So kann er nicht nur komplexere Bewegungen im Alltag wie z.B. das Zuknöpfen von Hemden oder das Aufheben von kleinen Münzen von einer flachen Oberfläche ausführen, sondern es hat sich auch sein Selbstbewusstsein und damit die Interaktion mit seiner Umgebung deutlich verbessert. Bisher konnten keine Zeichen einer Funktionsverschlechterung oder des Auftretens einer chronischen Abstoßung beobachtet werden. Das tägliche Leben wird vom Patienten als völlig normal bezeichnet, er ist in seinen Beruf wieder voll integriert und engagiert. Mit den transplantierten Händen unternahm er bereits mehrfach transkontinentale Motorradreisen. Das gesetzte Ziel wurde also erreicht und aus Sicht des Patienten war die Entscheidung zur Handtransplantation eindeutig richtig. Das Ergebnis nach Unterarmtransplantation ist ebenfalls zufriedenstellend, wenn auch mehrere akute Abstoßungen sowie Medikamentennebenwirkungen die Rehabilitation verkomplizierten. Mittlerweile konnte eine stabile Situation hergestellt und sämtliche Nebenwirkungen zum Verschwinden gebracht werden. Beeinträchtigt wird das Ergebnis durch die ungenügende Sensibilität. Es bleibt jedoch zu hoffen, dass es in dieser Hinsicht noch zu einer Funktionsverbesserung kommt.